
Медико-генетический центр
лаборатория молекулярной патологии
Связаться с нами
Связаться с нами
Бесплатная горячая линия:
Каждый год у миллионов здоровых пар рождаются дети с неизлечимыми генетическими заболеваниями. В большинстве случаев при таких патологиях один или оба родителя являются носителями мутаций.
Информацию о носительстве можно получить с помощью универсального генетического теста. Врач оценит риск рождения ребенка с наследственным заболеванием и даст рекомендации по его снижению.
Наследственные заболевания возможно предотвратить.

Мутации в генах наследуются нашими детьми
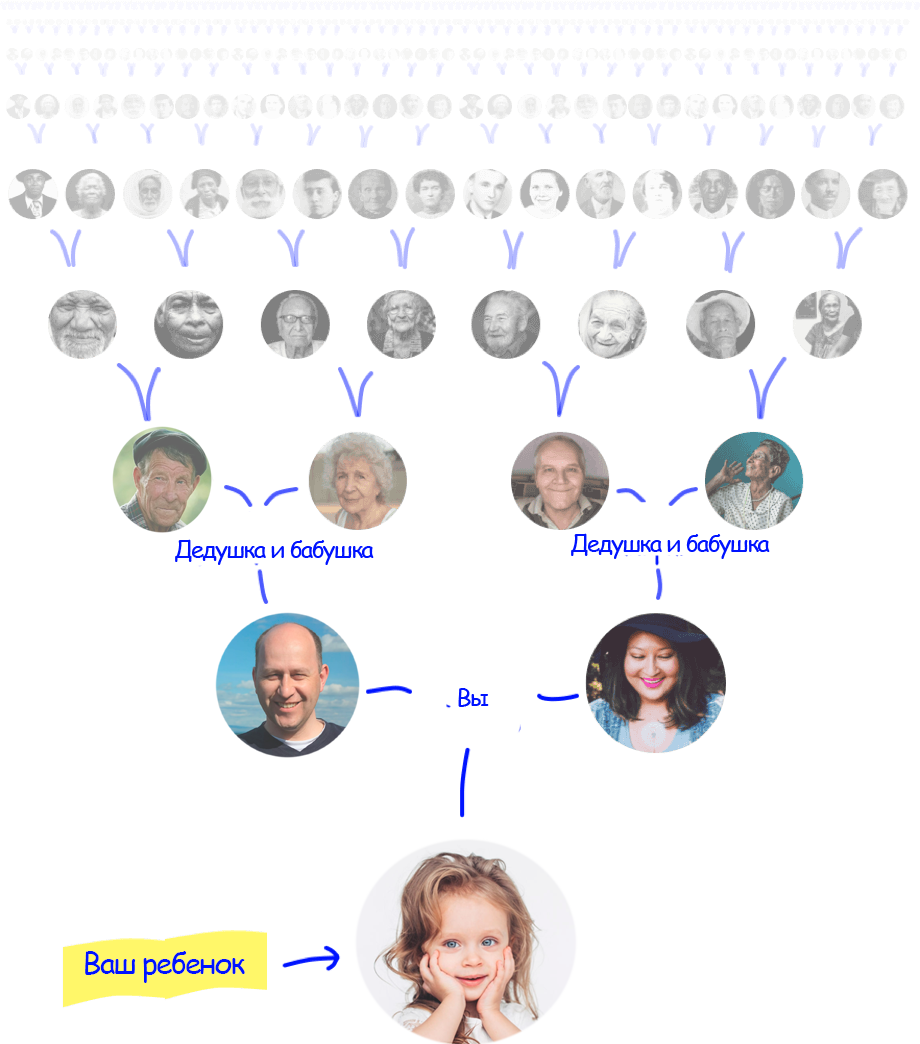
Дефектный ген может долгие годы передаваться из поколения в поколение, никак не проявляя себя до тех пор, пока не появится ряд условий, способствующих проявлению заболевания.
Для большинства наследственных заболеваний таким условием является вступление в брак двух носителей мутации в одном и том же гене — вероятность рождения ребенка с генетическим заболеванием составляет при этом 25%.
Наследственные заболевания
Большинство наследственных заболеваний неизлечимы, либо возможности их лечения ограничены.
У более чем 75% людей с аутосомно-рецессивными заболеваниями снижена продолжительность жизни. При некоторых состояниях гибель происходит внутриутробно или в первые дни после рождения.
Большинство из тестируемых заболеваний приводят к умственной отсталости, порокам развития и другим тяжелым проявлениям. Это синдром Смита-Лемли-Опица, спинальная мышечная атрофия, муковисцидоз и др.
Требуется постоянная коррекция хронических симптомов и осложнений.
Хотя для некоторых наследственных заболеваний лечение может быть разработано, нередко оно недоступно, имеет много побочных эффектов и не может облегчить симптомы.
Семейный анамнез не показатель
У большинства детей, рожденных с наследственным генетическим заболеванием, никогда не было таких же патологий в семейном анамнезе. Подобные болезни часто становятся для родителей ребенка неожиданностью.
Чаще, чем синдром Дауна
Риск рождения ребенка с одним из моногенных заболеваний выше риска рождения ребенка с синдромом Дауна.
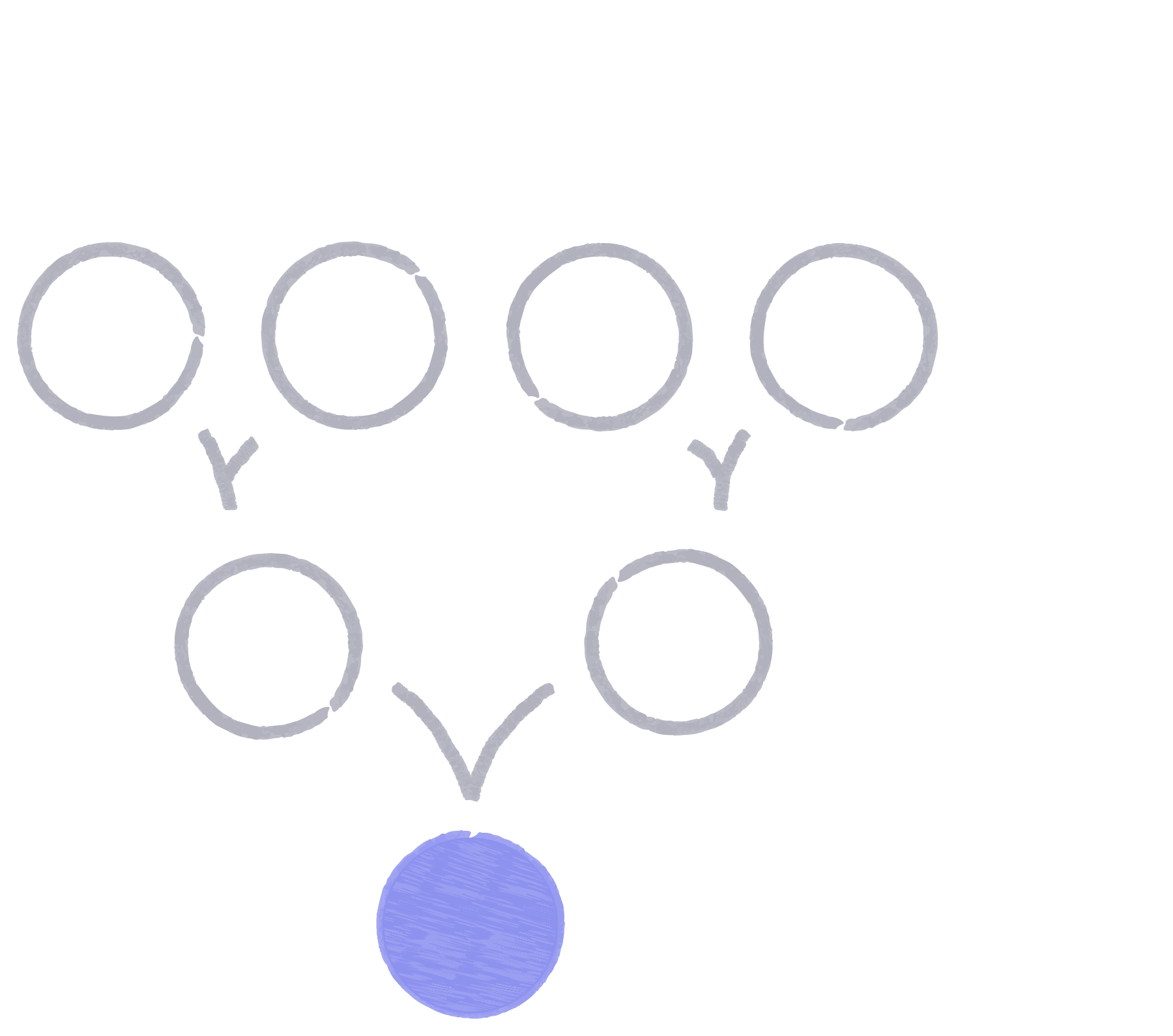

Около 1% детей рождаются с моногенной генетической патологией
Известно более 7 тысяч наследственных заболеваний. К счастью, многие из них достаточно редки. Для отдельных заболеваний описаны только единичные случаи, в то время как другие наследственные патологии встречаются достаточно часто. Это муковисцидоз, фенилкетонурия, спинальная мышечная атрофия.
Дети со СМА страдают от прогрессивной нервно-мышечной атрофии. Многие из них умирают в возрасте до двух лет, другие же остаются прикованными к коляске.

Tilda Publishing
Спинальная мышечная амиотрофия (СМА)
Тяжелая наследственная патология, при которой медь начинает откладываться во внутренних органах. В России известна как болезнь Вильсона-Коновалова. Причина заболевания — мутация в гене ATP7B, который отвечает за правильный метаболизм меди в организме. Наследуется по аутосомно-рецессивному типу.

Tilda Publishing
Болезнь Вильсона
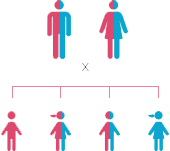
Здоровый отец,
носитель мутации
носитель мутации
Здоровая мать,
носитель мутации
носитель мутации
Здоровый ребенок,
вероятность 25%
вероятность 25%
Больной ребенок,
вероятность 25%
вероятность 25%
Здоровый ребенок,
носитель мутации, вероятность 50%
носитель мутации, вероятность 50%
Аутосомно-рецессивный
тип наследования
тип наследования
Одно заболевание может быть вызвано различными мутациями в одном и том же гене.
Так, например, известно более 100 мутаций в одном гене CFTR, которые вызывают развитие муковисцидоза.
Для каждой мутации, как правило, существует отдельный тест.
Исследования целесообразны для подтверждения заболевания при наличии у пациента его клинических признаков.
Так, например, известно более 100 мутаций в одном гене CFTR, которые вызывают развитие муковисцидоза.
Для каждой мутации, как правило, существует отдельный тест.
Исследования целесообразны для подтверждения заболевания при наличии у пациента его клинических признаков.
Как диагностировать наследственное заболевание
Для выявления патологий, которые связаны с наследственными заболеваниями, необходимо проанализировать несколько сотен, а иногда и тысяч различных мутаций.
Универсальный генетический тест позволяет определить от 30 до 3000 мутаций, вызывающих развитие наиболее распространенных наследственных заболеваний, которые нельзя излечить, но возможно предотвратить.
Тест рекомендован женщинам и мужчинам репродуктивного возраста.
Универсальный генетический тест позволяет определить от 30 до 3000 мутаций, вызывающих развитие наиболее распространенных наследственных заболеваний, которые нельзя излечить, но возможно предотвратить.
Тест рекомендован женщинам и мужчинам репродуктивного возраста.
Кому показан «Скрининг на носительство наследственных заболеваний»?
Будущим родителям, которые заботятся о рождении здорового ребенка при планировании беременности.
Донорам яйцеклеток и сперматозоидов.
Супругам, которые находятся в кровном родстве.
Семьям, имеющим ребенка либо родственника с наследственными заболеваниями.
Парам, столкнувшимся с бесплодием.
Беременным для своевременного определения риска наследственного заболевания у плода.



«Скрининг на носительство генетических заболеваний» следует рекомендовать всем парам, планирующим семью, независимо от того, есть ли у них что-либо в семейном анамнезе».
«Тест на определение носительства мутаций, связанных с наследственными болезнями, может существенно снизить число таких болезней и даже полностью избавить от некоторых из них».
«Профилактика заболеваний так же важна, как и поиск новых методов лечения и диагностики. В случае с генетическими заболеваниями это единственно возможный способ борьбы с ними».
— Профессор Паскуаль Патрицио
— Профессор Стивен Пинкер
— Профессор Сергей Коростелев
Директор Йельского центра репродукции
Врач-генетик, д.м.н., лаборатория «Геномед»
Гарвардский университет
Выберите Ваш «Скрининг на носительство наследственных заболеваний»
«Базовый»
Выявляет носительство галактоземии, муковисцидоза, фенилкетонурии, несиндромальной тугоухости и других аутосомно-рецессивных заболеваний.
Данные мутации наиболее распространены и все вместе являются причиной, вызывающей до 30% всех случаев наследственных заболеваний в популяции.
Тест рекомендован в первую очередь при планировании беременности.
Данные мутации наиболее распространены и все вместе являются причиной, вызывающей до 30% всех случаев наследственных заболеваний в популяции.
Тест рекомендован в первую очередь при планировании беременности.
и узнайте больше о каждом заболевании, как его можно диагностировать, чтобы принять своевременные меры
18 частых генетических заболеваний
32 патогенные мутации


7000 ₽
10 дней
«Экспертный»
Наиболее объемный и точный ДНК-тест на носительства генетических вариантов всех наследственных заболеваний.
Выявляет носительство спинальной мышечной атрофии (делеции 7-8 экзонов гена SMN1).
Позволяет определить носительство 98% всех патогенных генетических вариантов.
Выявляет носительство спинальной мышечной атрофии (делеции 7-8 экзонов гена SMN1).
Позволяет определить носительство 98% всех патогенных генетических вариантов.
Все клинически значимые гены


30 000 ₽
45 дней
«Расширенный»
Включает генетические варианты расположенные в кодирующих (экзоны, участки сплайсинга) и не кодирующих участках генов.
Данные генетические варианты все вместе являются причиной, вызывающей до 90% всех случаев наследственных заболеваний в популяции.
Выявляет носительство спинальной мышечной атрофии (делеции 7-8 экзонов гена SMN1).
Данные генетические варианты все вместе являются причиной, вызывающей до 90% всех случаев наследственных заболеваний в популяции.
Выявляет носительство спинальной мышечной атрофии (делеции 7-8 экзонов гена SMN1).
560 генетических заболеваний
7000 патогенных мутации


16 000₽
30 дней
Число копий гена SMN1

Все патогенные/вероятно патогенные варианты

Число копий гена SMN1
Как пройти генетический тест?
Получить консультацию специалиста по телефону
+7 (800) 333-45-38
+7 (800) 333-45-38
Выбрать тест
Заполнить форму на сайте и оплатить тест.
Также это можно сделать
в наших медицинских офисах
Также это можно сделать
в наших медицинских офисах
Получить набор, собрать материал и отправить его в лабораторию
Посетить один из наших медицинских офисов
Обсудить результат с врачом
Тест можно сдать в нашем медицинском офисе или у вас дома.
Понадобится только ваша слюна.
Никакой крови, никаких игл!
Никакой крови, никаких игл!
1
2
3
4
4
5
или

Сообщество медицинских генетиков (ACMG) и акушеров и гинекологов (ACOG) рекомендуют всем женщинам проходить скрининг на наследственные заболевания:
«Всех беременных или планирующих беременность женщин следует информировать о скрининге на носительство».

Почему стоит выбрать лабораторию «Геномед»?

Наибольший опыт

Профессионализм
Исследования и консультации проводят кандидаты и доктора медицинских наук

Современные технологии
Используем только проверенные и валидированные тесты

Высокая компетенция
Специализируемся только на генетических тестах

Простота в обращении
Множество медицинских офисов, партнеры по всей России.
Служба клиентского сервиса работает 24 часа 7 дней в неделю 365 дней в году
Служба клиентского сервиса работает 24 часа 7 дней в неделю 365 дней в году
13 лет на рынке лабораторной диагностики
НИПТ Panorama



Осложнения при беременности
Консультация генетика
Неинвазивный пренатальный тест. Выявляет риск развития генетических аномалий у плода уже на сроке беременности 9 недель.
Некоторые генетические варианты могут предрасполагать к выкидышу, преждевременным родам, эклампсии и другим осложнениям при беременности.
Спросите врача-генетика о возможностях генетических тестов и их результатах.
Другие генетические тесты

